Введите слово или словосочетание на любом языке 👆
Язык:
Перевод и анализ слов искусственным интеллектом ChatGPT
На этой странице Вы можете получить подробный анализ слова или словосочетания, произведенный с помощью лучшей на сегодняшний день технологии искусственного интеллекта:
- как употребляется слово
- частота употребления
- используется оно чаще в устной или письменной речи
- варианты перевода слова
- примеры употребления (несколько фраз с переводом)
- этимология
Что (кто) такое Изомеры - определение
СУЩЕСТВОВАНИЕ ХИМИЧЕСКИХ СОЕДИНЕНИЙ, ОДИНАКОВЫХ ПО АТОМНОМУ СОСТАВУ И МОЛЕКУЛЯРНОЙ МАССЕ, НО РАЗЛИЧАЮЩИХСЯ ПО СТРОЕНИЮ ИЛИ РАСПОЛОЖЕНИЮ
Изомеры; Энантиометр; Оптические изомеры; Пространственная изомерия; Структурная изомерия; Транс-изомеры; Цис-изомеры; Изомер; Структурные изомеры; Метамерия (химия)
Найдено результатов: 31
Изомеры
химические соединения, одинаковые по составу и молекулярной массе, но различающиеся по строению и свойствам (химическим и физическим). Подробнее см. Изомерия химических соединений. О ядерных И. см. Изомерия атомных ядер.
ИЗОМЕРЫ
см. в ст. Изомерия.
изомеры
мн.
Химические соединения, имеющие одинаковый состав и молекулярную массу, но различающиеся физическими и химическими свойствами.
Химические соединения, имеющие одинаковый состав и молекулярную массу, но различающиеся физическими и химическими свойствами.
ИЗОМЕРИЯ
и, мн. нет, ж., хим.
Явление, заключающееся в существовании изомеров.
ИЗОМЕРИЯ
(от изо ... и греч. meros - доля, часть) химических соединений, явление, заключающееся в существовании изомеров - соединений, одинаковых по составу и молекулярной массе, но различающихся по строению (структурная изомерия) или расположению атомов в пространстве (пространственная изомерия) и, следовательно, по свойствам. Открыта в 1823 Ю. Либихом, показавшим, что фульминат серебра AgONC и изоцианат серебра AgNCO имеют один и тот же состав, но разные свойства. Термин "Изомерия" предложен в 1830 Й. Берцелиусом.
Изомерия
Изомерия (хим.). - В 1824 г. Либихом и Гей-Люссаком был установленсостав гремуче-кислого серебра, причем, на основании полученных данных,они признали безводную гремучую кислоту за соединение циана с кислородомC4N2O2 (C=6, 0=8, N=14). В том же году Веллер более точными анализамисолей циановой кислоты, открытой им в 1822 г., показал, что и безводнаяциановая кислота, по элементарному составу, представляет соединениециана с кислородом, C2NO (С=6, О=8, N=14). Таким образом, впервые былиполучены вещества одного и того же элементарного и процентного состава,но различных свойств (соли гремучей кислоты взрывают с большой энергиейот легкого толчка, между тем как соли циановой кислоты совершенно лишеныэтой способности). Хотя Гей-Люссак, реферируя в "Annales de chimie et dephisique" (27, {2}, 200) работу Веллера, и указал на возможностьобъяснения этого явления допущением различного способа соединения междуэлементами, образующими гремучую и циановую кислоты, тем не менее оно настолько противоречило существовавшему в то время в химии положению, чтосвойства тел обусловливаются их элементарным и процентным составом, чтоБерцелиус, не колеблясь (в появившемся тогда новом издании своего"Traite de Chimie"), объявил, что в данные Гей-Люссака и Либиха илиВеллера вкрались ошибки; понадобились новые анализы, произведенныеЛибихом в 1826 г., чтобы доказать тожество состава гремучих и циановыхсолей. К 1826 г., впрочем, было уже известно другое, вполне аналогичноеявление. Фарадей в 1825 г., исследуя жидкость, скопившуюся в цилиндрах,в которых сохранялся сдавленный светильный газ, нашел в ней, вместе сбензолом, вещество С4Н8, одинакового состава с этиленом С2Н4 нообладавшее удвоенною сравнительно с последним плотностью пара. Затем, в1828 г., Веллеру удалось наблюсти, что циaновокислый аммоний CNO.NH4(С=12, 0=16, N=14, Н=1) нацело превращается в водных растворах вмочевину CO(NH2)2, и, наконец, в 1830 г. Берцелиус, исследуя винограднуюкислоту, нашел, что как сама свободная кислота, так и ее свинцовая сольобладают одинаковым процентным составом с винной кислотой и виннокислымсвинцом, между тем как свойства и свободных кислот и их солей довольносильно различаются между собою. Этими наблюдениями окончательно былаустановлена возможность существования различных по свойствам, нотожественных по элементарному и процентному составу, химическихсоединений, и в отчете по химии, представленном шведской академии наук в1831 г., Берцелиус замечает по этому поводу, что "так как необходимо длякаждого известного представления обладать определенным выражением,выбранным по возможности рационально, то я предлагаю называть телаодного состава, по различных свойств, изомерными (от греческого словаisomerhV - составленный из равных частей)". Уже в следующем году он даетболее ограниченное определение нового понятия. "Чтобы не смешать,однако, друг с другом явления не вполне однородные", говорит он,"необходимо точно установить значение слова - И. Я считаю изомерными тетела, который образованы из одинаковых атомов, соединенных в одинаковыхотносительных и абсолютных количествах, которые обладают одинаковымвесом атома. С этим случаем нельзя смешивать того, когда в двух телахсодержатся одинаковые относительные количества элементарных тел, приразном абсолютном содержании этих последних. Так, напр., относительноечисло атомов углерода и водорода в маслородном газе (этилене) и в винноммасле (бутилене) тожественно, но в одном из них содержится только одинатом углерода, 2 атома водорода СН2, между тем как в винном масленаходятся 4 атома углерода и 8 атомов водорода C4H8. Для отличияподобных случаев одинаковости состава при различии в других свойствах, япредложил бы называть их полимерными (от греч. polluV - множественный иmeroV - часть)... Но существуют и другие отношения, при которых тела,по-видимому изомерные в строгом смысле этого слова, т. е. содержащиеодинаковые элементы и абсолютно тожественные количества атомов, на самомделе не являются таковыми. Подобные случаи наблюдаются для тел,образованных соединением двух атомов первого порядка..., напр. SnO.SO3 -сернокислая закись олова, и SnО2.SO2 - основная сернисто-кислая сольокиси олова, содержат одинаковые абсолютные и относительные количестваатомов одних и тех же элементов, имеют одну и ту же частицу, а между темих нельзя считать за одно вещество. В таких телах с течением времени,или с изменением темпер., происходит обыкновенно перемещение ихсоставных частей, иногда сопровождаемое повышением темпер., вследствиечего образуются новые соединения. Чтобы резко отличить эти случаи отявлении И., можно подобные тела назвать метамерными (употребляя предлогmeta с тем же значением, которое он имеет в слове метаморфоза)". С техпор, с развитием органической химии, фактические сведения о телах,обладающих различными свойствами при тожественном составе, чрезвычайновозросли (так, напр., в 1884 г. В. Мейер насчитал 55 различныхсоединений, отвечающих общей формуле C9H10O3, а в течение 10 лет эточисло значительно увеличилось), но нельзя сказать, чтобы понятия,введенные в химию Берцелиусом, выиграли в ясности и определенности.Впрочем, надо заметить, что и те примеры, на основании которых былиустановлены эти понятия, оказались неудачно выбранными; теперь мы знаем,что виноградная кислота обладает удвоенною частицею сравнительно собыкновенною винною кислотою, но что кроме того ее нельзя рассматриватькак полимерную винную кислоту потому, что она образована соединениемоптически противоположных, правой и левой винных кислот. циановаякислота и гремучая кислота обладают тоже различною величиною частиц, приразличном строении, а циановокислый аммоний и мочевина представляют теларазличных функций и, по современным структурным представлениям, содержатразличные группы атомов (различные остатки), а именно строение 1-говыражается формулой N : C - O. NH4, а второй - формулой NH2. CO. NH2.Изомерными теперь называют вообще все тела одного и того же процентногосостава и одной и той же частичной формулы и отличают: 1) изомерысобственно, когда при одной и той же частичной формуле вещества обладаютоднородной химической функцией; 2) изомеры случайные, когда при одной итой же частичной формуле они обладают различной химической функцией, и3) метамеры - вещества, обладающие одной и той же частичной формулой,одной и той же химической функцией, но (как выражаются иногда) нецельнойчастицей. Вещества, обладающие при одинаковом процентном составеразличными частичными формулами, т. е. полимерные между собою, непричисляются более к изомерам. Такое деление, однако, далеко необщепринятое. Очень часто, напр., спирты и эфиры одной с ними частичнойформулы назыв. метамерными соединениями (Бернтсен); в руководствеБейльштейна "Handbuch der Org. Chemie" (3-te Aufl. S. 5): изомерами, втесном смысле этого слова, согласно определению Бутлерова и Клауса,сочтены только соединения, в которых углеродные атомы связаны одинаково,а другие элементы сгруппированы различным образом, каковы: CH3. CH2.CH2(OH) - пропиловый спирт и СН3. СН(ОН). СН3 - изопропиловый спирт;метамерными же названы соединения, в которых углеродные атомы связаныразличным образом, а тожественно сгруппированы остальные, соединенные суглеродом элементы, и как примеры приведены СH3. CH2. CH2. CH2(OH) -нормальный бутиловый и (СН3)2: СН. CH2(OH) - изобутиловый спирты;наконец, изометамерными названы изомеры, в которых и углеродные атомы, иатомы остальных элементов связаны различным образом, как, напр., внормальном бутиловом спирте - СН3. СН2. СН2. СН2(ОН) и втриметилкарбиноле - (СН3)3 : С(ОН). Неудобство такого определениясовершенно ясно; приняв его, мы должны признать, что междууглеводородами возможны только случаи метамерии и изометамерии, а этосовершенно несогласно с установившимся обычаем. Можно было бы привестиеще несколько аналогичных примеров не менее произвольных определений (иоснованных на них классификаций); достаточно, однако, и перечисленных,чтобы видеть, что значения, приобретенные словами: И. и метамерия,значительно уклонились от того смысла, который им придавал Берцелиус икоторый они должны иметь по самому словопроизводству. Строго говоря,раз, по современным воззрениям, мы допускаем возможность знать ближайшеераспределение элементов в. частицах данного вещества - его "структуру", то изомерами, в органической химии, по крайнеймере, можно называть только те тела, структурные формулы которыхсодержат одни и те же группы атомов, т. е. тожественные остатки: СН3,СН?2, CН?ў, СО?, (СОН)ў, (СООН)ў, (ОН)ў, О. и т. д.; метамерными же, всмысле Берцелиуса, можно называть только тела, способные к превращениюдруг в друга с сохранением одной и той же величины частицы. При такомопределении, изомерами из числа бутиловых спиртов, напр., являлись бытолько (CH3)2:CH. CH2 (OH) - изобутиловый спирт, и CH3. CH2. CH(OH). CH3- псевдобутиловый (вторично-бутиловый) спирт, метамерами же, еслиограничиться уже приведенными примерами - циановокислый аммоний имочевина. Для огромного, однако, числа веществ, теперь причисляемых кизомерным, не было бы соответственного названия, а потому заслуживаютбольшего внимания следующие предложения Армстронга. Он предлагаетназывать все случаи различия свойств веществ, при тожестве их состава,не И., а аллотропией (от греческого аллотропос, что значит - обладающийотличными свойствами, слово же И. употреблять в том тесном смысле,который только что изложен, включая следовательно сюда и все явленияпространственной И., вещества же аллотропичные (изомерные), но различныепо функции или по типу, к которому они принадлежат, Армстронг называетгетерометричными, оставляя название метамерных или изодинамичных для техиз них, которые превращаются друг в друга с исключительной легкостью.Все же остальные случаи, где аллотропичные вещества обладают одной и тойже функцией, но образованы соединением нетожественных групп, он считаетвозможным называть изономичными А. И. Горбов.
Изомерия
Изомери́я (от — равный + — доля, часть) — явление, заключающееся в существовании химических соединений — изомеров, — одинаковых по атомному составу и молекулярной массе, но различающихся по строению или расположению атомов в пространстве и, вследствие этого, по свойствам.
ПРОСТРАНСТВЕННАЯ ИЗОМЕРИЯ
(стереоизомерия) , один из видов изомерии химических соединений. Обусловлена различиями в расположении атомов в пространстве (при одинаковой последовательности связи атомов). Подразделяется на диастереомерию и энантиомерию.
Изомерия
(от Изо... и греч. méros - доля, часть)
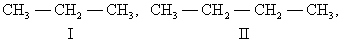
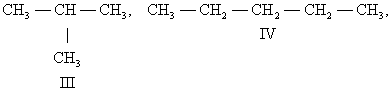
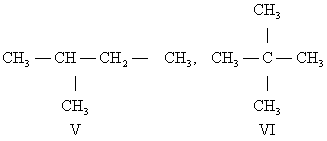
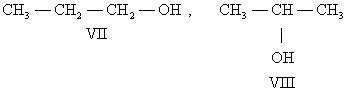


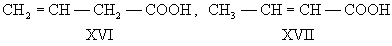
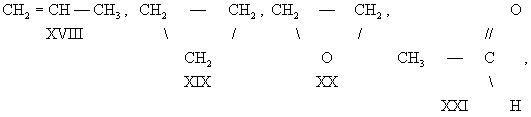
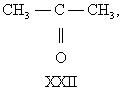
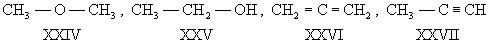

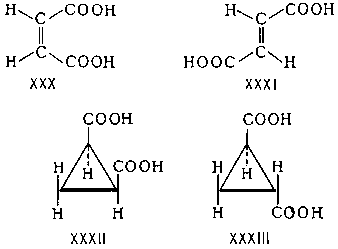
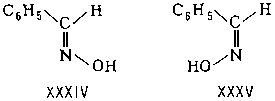
--------------------------------------------------------------------------------------------------------------------------------------------------------------
| Свойства | Малеиновая кислота (цис- | Фумаровая кислота (транс- |
| | форма) | форма) |
| -------------------------------------------------------------- ------------------------------------------- --------------------------------------------------- |
| Температура плавления, °С | 130 | 286 |
| -------------------------------------------------------------- ------------------------------------------- --------------------------------------------------- |
| Растворимость в 100 г воды при 20 | | |
| °С, г | 78,8 | 0,7 |
| -------------------------------------------------------------- ------------------------------------------- --------------------------------------------------- |
| Константа диссоциации при 25°С(К1) | 1,17·10-2 | 9,3·10-4 |
| -------------------------------------------------------------- ------------------------------------------- --------------------------------------------------- |
| Теплота сгорания, кдж/моль ( | | |
| ккал/моль) | 1,35(326) | 1,34(320) |
--------------------------------------------------------------------------------------------------------------------------------------------------------------
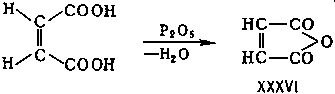
------------------------------------------------------------------------------------------------------------
| I | II | III | IV |
| -------------------------- --------------------------- -------------------------- ---------------------------- |
| -A | -A | +A | +A |
| -------------------------- --------------------------- -------------------------- ---------------------------- |
| -B | +B | +B | -B |
------------------------------------------------------------------------------------------------------------


химических соединений, явление, заключающееся в существовании веществ, одинаковых по составу и молекулярной массе, но различающихся по строению или расположению атомов в пространстве и вследствие этого по физическим и химическим свойствам. Такие вещества называются изомерами.
И. открыта в 1823 Ю. Либихом, показавшим, что серебряная соль гремучей кислоты Ag - О - N = C и изоцианат серебра Ag - N = C = O имеют один и тот же состав, но совершенно разные свойства. Термин "И." предложен в 1830 И. Берцелиусом. Особенно распространена И. среди органических соединений. Явление изомерии было успешно объяснено теорией химического строения, разработанной в 60-х гг. 19 в. А. М. Бутлеровым.
Различают два основных вида И.: структурную и пространственную (стереоизомерию). Структурные изомеры отличаются друг от друга порядком связей между атомами в молекуле; стереоизомеры - расположением атомов в пространстве при одинаковом порядке связей между ними.
Структурная И. подразделяется на несколько разновидностей. И. скелета обусловлена различным порядком связи между атомами углерода, образующими скелет молекулы. Так, может существовать только один нециклический насыщенный углеводород с тремя атомами С - пропан (I). Углеводородов такого же типа с четырьмя атомами С может быть уже два: н-бутан (II) и изобутан (III), а с пятью атомами С - три: н-пентан (IV), изопентан (V) и неопентан (VI):
Для углеводорода C20H42 возможно уже 366 319 изомеров.
И. положения обусловлена различным положением какой-либо реакционноспособной группы (функциональной группы, заместителя) при одинаковом углеродном скелете молекул. Так, пропану соответствуют два изомерных спирта: н-пропиловый (VII) и изопропиловый (VIII):
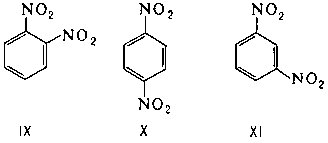
Важную роль играет И. положения у соединений ароматического ряда, так как положение заместителей в бензольном ядре - один из главных факторов, определяющих реакционную способность вещества. Например, о-динитробензол (IX) и n-динитробензол (X) легко реагируют с аммиаком, тогда как м-динитробензол (XI) в реакцию с NH3 не вступает.
В ряду алифатических простых эфиров, сульфидов и аминов существует специальный вид И. - метамерия, обусловленная различным положением гетероатома в углеродной цепи. Метамерами являются, например, метилпропиловый (XII) и диэтиловый (XIII) эфиры:
Термин "метамерия" применяется всё реже.
И. непредельных соединений может быть вызвана различным положением кратной связи, как, например, в бутене-1 (XIV) и бутене-2 (XV), в винилуксусной (XVI) и кротоновой (XVII) кислотах:
В большинстве случаев структурные изомеры сочетают признаки И. скелета и И. положения, содержат различные функциональные группы и принадлежат к разным классам веществ, вследствие чего они отличаются друг от друга значительно больше, чем рассмотренные выше изомеры веществ одного и того же типа. Например, изомерами являются пропилен (XVIII) и циклопропан (XIX), окись этилена (XX) и ацетальдегид (XXI), ацетон (XXII) и пропионовый альдегид (XXIII), диметиловый эфир (XXIV) и этиловый спирт (XXV), аллен (XXVI) и метилацетилен (XXVII):
Особым видом структурной И. является таутомерия (См. Транс-) (равновесная динамическая И.) - существование вещества в двух или более изомерных формах, легко переходящих друг в друга. Так, ацетоуксусный эфир существует в виде равновесной смеси кетонной (XXVIII) и енольной (XXIX) форм:
Пространственная И. подразделяется на два вида: геометрическую И. (или цис-транс (См. Цис-транс-изомерия)-И.) и оптическую И. Геометрическая И. свойственна соединениям, содержащим двойные связи (С = С, C = N и др.), и неароматическим циклическим соединениям; она обусловлена невозможностью свободного вращения атомов вокруг двойной связи или в цикле. В этих случаях заместители могут быть расположены либо по одну сторону плоскости двойной связи или цикла (цис (См. Цис-)-положение), либо по разные стороны (транс (См. Транс-)-положение). Понятия "цис" и "транс" обычно относят к паре одинаковых заместителей, а если все заместители разные, то условно к одной из пар. Примерами геометрических изомеров могут служить две формы этилен-1,2-дикарбоновой кислоты - цис (См. Цис-)-форма, или малеиновая кислота (XXX), и транс (См. Транс-)-форма, или фумаровая кислота (XXXI), а также цис (См. Цис-)- и транс (См. Транс-)-формы циклопропан-1,2-дикарбоновой кислоты (соответственно XXXII и XXXIII):
Для обозначения изомерных соединений, содержащих связи C = N или N = N, часто вместо цис (См. Цис-) и транс (См. Транс-) применяют термины соответственно син и анти (См. Анти...). Так, в молекуле син-бензальдоксима (XXXIV) атом водорода при углероде и гидроксильная группа при азоте расположены по одну сторону плоскости, проходящей через C = N-cвязь, а в молекуле анти (См. Анти...)-бензальдоксима (XXXV) - по разные стороны этой плоскости:
Геометрические изомеры обычно существенно различаются по физическим свойствам (температурам кипения и плавления, растворимости, дипольным моментам, термодинамической устойчивости и др.). В таблице приведены некоторые свойства геометрических изомеров - малеиновой и фумаровой кислот.
Некоторые физические свойства малеиновой и фумаровой кислот
Для непредельных соединений возможны переходы цис (См. Цис-)-формы в транс (См. Транс-)-форму и обратно; так, под воздействием небольших количеств йода, галогеноводородов или других реагентов менее устойчивая, лабильная, форма переходит в более стабильную, тогда как облучение ультрафиолетовым светом способствует обратному превращению. Геометрические изомеры различаются и некоторыми химическими свойствами. Так, малеиновая кислота, у которой карбоксильные группы пространственно сближены, легко образует малеиновый ангидрид
тогда как фумаровая кислота ангидрида не даёт.
Оптическая И. свойственна молекулам органических веществ, не имеющим плоскости симметрии (плоскости, разделяющей молекулу на две зеркально тождественные половины) и не совмещающимся со своим зеркальным отображением (т. е. с молекулой, соответствующей этому зеркальному отображению). Такие асимметричные молекулы обладают оптической активностью (См. Оптическая активность) - способностью к вращению плоскости поляризации света при прохождении поляризованного луча через кристалл, расплав или раствор вещества.
Оптической активностью обладают кристаллы некоторых неорганических веществ, например кварца, однако оптическая активность в этом случае обусловлена асимметрией кристаллической решётки и исчезает при переходе вещества в другие агрегатные состояния. Оптическая И. органических веществ зависит только от строения молекул и с агрегатным состоянием не связана. Голландский химик. Я. Вант-Гофф впервые предложил (1874) объяснение оптической активности на основе тетраэдрической модели атома углерода.
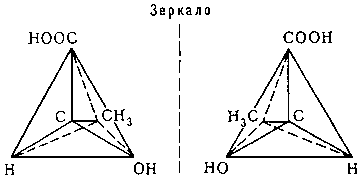
Чаще всего оптическая активность обусловлена наличием в молекуле асимметричного атома углерода, т. е. атома углерода, связанного с четырьмя различными заместителями. Примером может служить молочная кислота: CH3C*H(OH)COOH (асимметрический атом углерода отмечен звёздочкой). Согласно тетраэдрической модели атома углерода, заместители располагаются в углах правильного тетраэдра, в центре которого находится атом углерода:
Как видно из приведённых формул, молекула молочной кислоты ни при каком перемещении в пространстве не может совпасть со своим зеркальным отображением. Эти две формы кислоты относятся друг к другу, как правая рука к левой, и называются оптическими антиподами (энантиомерами).
Все химические свойства оптических антиподов идентичны; одинаковы и их физические свойства, за исключением оптической активности: одна форма вращает плоскость поляризации света влево [l-или (-)-форма], другая - на тот же по величине угол вправо [d-или (+)-форма]. Ясно, что две формы одного и того же вещества с противоположными знаками вращения имеют зеркально-противоположные Конфигурации. Одинаковый знак вращения разных веществ не служит доказательством сходства их конфигураций, а вещества с противоположным знаком вращения могут иметь одинаковые конфигурации, как, например, левовращающая молочная кислота и её правовращающие эфиры.
Для обозначения генетической связи веществ применяют знаки L и D, показывающие конфигурационное родство определённого оптически активного вещества с L-или D-глицериновым альдегидом или соответственно с L-или D-глюкозой. Левовращающая молочная кислота оказывается принадлежащей к D-pяду и обозначается как D-(-)-молочная кислота, правовращающая - к L-pяду и обозначается как L-(+)-moлочная кислота.
Смесь равных количеств оптических антиподов ведёт себя как индивидуальное химическое соединение, лишённое оптической активности и сильно отличающееся по физическим свойствам от каждого из антиподов. Такое вещество называется рацемическим соединением, или рацематом [d, l- или (±)-форма]. При всех химических превращениях, при которых образуются новые асимметричные атомы углерода, всегда получаются рацематы, так как вероятности образования правовращающей и левовращающей форм равны.
В случае соединений типа abcC' - C''def, содержащих два асимметричных центра, возможны следующие четыре изомера соответственно конфигурации асимметричных атомов C' и С'': левый - левый (I), левый - правый (II), правый - правый (III) и правый - левый (IV):
(А и В обозначают соответственно атомы C' и С'').
Формы I и III, II и IV - оптические антиподы. Формы I и II, I и IV, II и III не являются антиподами, так как конфигурации одного асимметричного центра у них противоположны, а другого совпадают. Такие оптические изомеры называются диастереоизомерами, или диастереомерами (См. Диастереомеры). Диастереомеры резко различаются по всем важнейшим физическим свойствам. Если же заместители при двух асимметричных центрах одинаковы, т. е. в случае соединений типа abc - C' - С'' - abc [например, Винные кислоты НООСС*Н(ОН)C*H(ОН)СООН], формы II и IV совпадут и дадут оптически недеятельную форму (мезо (См. Мезо...)-форму), так как оптическая активность одного центра (C') компенсируется равной по величине и противоположной по знаку активностью другого центра (С'').
Рацемические соединения могут быть расщеплены на оптические антиподы. Для этого обычно используют реакции с оптически активными веществами.
Оптическая И. играет важнейшую роль в биологических процессах. Оптически активными являются природные аминокислоты, углеводы, алкалоиды и др.
Оптическая И. циклических соединений тесно связана с геометрической И.; так, транс (См. Транс-)- форма дизамещённого циклического соединения (например, XXXIII) не совпадает со своим зеркальным отображением.
Химическими методами можно определить относительную конфигурацию вещества, т. е. принадлежность его к D- или L-ряду. Вопрос же об абсолютной конфигурации, т. е. о действительном расположении заместителей в пространстве вокруг асимметричного центра, решается физическими методами - на основании данных дисперсии оптического вращения и рентгеноструктурного анализа. Оптическая И. может быть обусловлена не только наличием асимметричных атомов, но и асимметрией молекулы в целом, как, например, у замещенных алленов и спиранов:
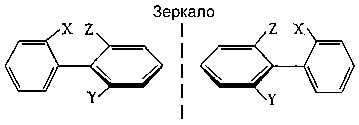
У производных дифенила, имеющих объёмистые заместители в орто-положении, возможно существование оптических изомеров вследствие затруднённости вращения бензольных колец:
Данный вид оптической изомерии называется атропоизомерией (по существу, это частный случай поворотной И.).
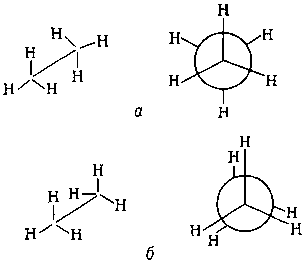
Поворотная И. обусловлена ограниченным вращением в молекуле атомов или групп атомов вокруг углерод-углеродной (или любой другой) простой связи. Геометрические формы, которые принимает при этом молекула, называются конформациями, а соответствующие структуры - конформерами (конформационными, вращательными, или поворотными изомерами). Существование предпочтительных конформаций связано с взаимодействием валентно не связанных между собой атомов и групп атомов. Теоретически молекула может принимать бесчисленное множество конформаций, однако реализуются обычно немногие, выгодные энергетически. Например, из всех возможных конформаций этана энергетически наиболее выгодна заторможенная конформация (а), наименее - заслонённая (б):
(заторможенная конформация обладает минимальной энергией, заслонённая - максимальной; у большинства соединений устойчивыми формами являются заторможенные конформации). Разность энергий между конформациями а и б составляет 11,7 кдж/моль (2,8 ккал/моль); это энергетический барьер вращения вокруг связи С-С в этане, т. е. энергия, необходимая для перехода из одной устойчивой (заторможенной) конформации в другую. При вращении групп CH3 на 360° друг относительно друга молекула этана трижды принимает каждую из указанных конформации. В этане все три устойчивые конформации идентичны. Для замещенных этанов, например для 1,2-дихлорэтана, они уже не все равноценны (возможны две заторможенные конформации и одна заслонённая). Так, трансоидная конформация (в) выгоднее скошенной, или гош-конформации (г), на 5,02 кдж/моль (1,2 ккал/моль), разность же между энергиями трансоидной (в) и заслонённой (д) конформации составляет 20,93 кдж/моль (5 ккал/моль):
За исключением рассмотренного выше случая атропоизомерии, энергетические барьеры конформационных переходов недостаточно велики, чтобы поворотные изомеры можно было выделить, однако их можно наблюдать, например, методами инфракрасной спектроскопии и особенно ядерного магнитного резонанса (часто только при пониженной температуре). Исследование конформационных состояний имеет большое значение при изучении физико-химических свойств веществ и их реакционной способности. См. Конформационный анализ.
Лит.: Илиел Э., Стереохимия соединений углерода, пер. с англ., М., 1965; Терентьев А. П., Потапов В. М., Основы стереохимии, М.-Л., 1964.
Б. Л. Дяткин.
Википедия
Изомерия
Изомери́я (от др.-греч. ἴσος — равный + μέρος — доля, часть) — явление, заключающееся в существовании химических соединений — изомеров, — одинаковых по атомному составу и молекулярной массе, но различающихся по строению или расположению атомов в пространстве и, вследствие этого, по свойствам.






